

日期:2025-03-21来源:
近日,我校合成生物学学院信息化合物合成生物学团队卫青教授课题组在纤毛中央微管形成机制研究方面取得重要突破。相关研究成果以 “Ccdc13 is essential for the assembly of ciliary central microtubules” 为题,发表于National Science Review。该研究借助果蝇和小鼠模型,首次揭示了 Ccdc13 在进化上保守的调控纤毛中央微管的形成及机制,为深入理解纤毛中央微管形成及相关纤毛病的致病机理奠定了理论基础。
纤毛(Cilia)是真核生物细胞表面广泛存在的一种基于微管的毛发状细胞器。依据运动能力的有无,纤毛可分为不动纤毛和运动纤毛。不动纤毛作为细胞的 “天线”,在生殖、发育和感知等生命过程中扮演着关键角色,负责感受并传递细胞外信号。而运动纤毛,诸如精子鞭毛、呼吸道上皮细胞纤毛以及脑室管膜上皮细胞纤毛等,主要通过自身摆动产生推力,实现细胞运动或介导细胞表面液体流动。运动纤毛功能缺陷会引发雄性不育、呼吸道功能障碍、脑积水等原发性纤毛运动障碍症(primary ciliary dyskinesia,PCD)。
大多数运动纤毛的轴丝具有典型的“9+2”型微管结构,即由9对双联体微管环绕 1 对中央单微管构成。中央微管在纤毛的节律性运动调控中发挥着不可或缺的作用。与外周微管不同,中央微管并非源自纤毛基体微管的延伸,而是属于“非中心体微管”,其形成过程缺乏模板,具体组装机制至今仍不明晰。
卫青教授课题组以果蝇为模型开展研究,发现利用CRISPR/Cas9基因编辑技术敲除Ccdc13 基因的雄性果蝇完全丧失生育能力。通过透射电子显微镜对精子鞭毛轴丝超微结构观察显示,Ccdc13 缺失导致精子鞭毛中央微管完全消失(图1),而外围双联体微管结构保持正常,这表明 Ccdc13 特异性调控中央微管的形成。由于突变体精子鞭毛中央微管缺失,致使鞭毛运动异常,最终造成雄性不育。进一步的机制研究表明,Ccdc13 定位于精子鞭毛中央微管,通过与微管结合蛋白 Spef1(Sperm Flagellar 1)直接相互作用,促进中央微管的延伸。
为探究 Ccdc13 功能在进化过程中的保守性,研究团队构建了 Ccdc13 基因敲除小鼠模型。研究结果显示,Ccdc13 缺失的小鼠脑室管膜上皮细胞纤毛中出现了中央微管缺失现象(图2),进而导致纤毛运动异常,最终引发脑积水。这一发现证实了 Ccdc13 在果蝇和哺乳动物中的功能具有高度进化保守性。该研究首次发现Ccdc13 在进化上保守的调控纤毛中央微管的组装,并揭示了 Ccdc13-Spef1 复合体是果蝇和哺乳动物中保守的中央微管形成调控模块。
鉴于Ccdc13在纤毛运动中的关键作用,其很可能是运动纤毛相关人类疾病的重要致病基因。因此,该研究不仅为纤毛疾病的诊断提供了新的依据,也为通过合成生物学技术调控纤毛运动、治疗纤毛相关疾病开辟了潜在的新途径。
合成生物学学院特聘教授吴志卯与中科院分子植物科学卓越创新中心已毕业博士生张颖颖为论文共同第一作者。卫青教授、中国科学院分子细胞科学卓越创新中心朱学良研究员、上海交通大学新华医院鄢秀敏研究员为该论文的共同通讯作者。浙江大学附属儿童医院谢珊珊研究员为该项研究提供了重要支持。该研究得到了国家自然科学基金青年项目和面上项目的资助。

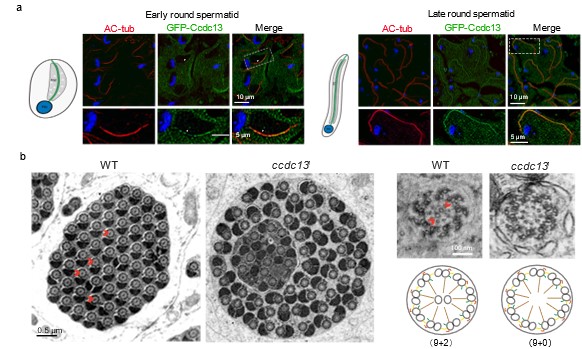
图1. Ccdc13缺失导致果蝇精子鞭毛中央微管缺失

图2. Ccdc13在哺乳动物中保守调控中央微管的形成
撰稿人:吴志卯
二 审:吴云彬
三 审:张建珍